
Известно, что если не принять определенные меры, кузов автомобиля за 4-5 лет может превратиться буквально в ржавое сито. Ни лакокрасочные покрытия, ни мастика зачастую не помогают, так как кузов имеет множество закрытых полостей, полостей, карманов и коробов, а дорожная грязь и влага смешиваются с поваренной солью, создавая там идеальные условия для электрохимической коррозии. А учитывая толщину современных автомобильных стальных пластин, это может привести к очень быстрому выходу их из строя.
Однако вы можете не только защитить себя от коррозии с помощью брони из лака или хрома, но и обмануть коррозию, подсунув в качестве приманки такие лакомые кусочки, как металлы с более высоким электродным потенциалом.
О катодной защите кузова я ранее писал здесь>>>, но на этот раз хотелось бы немного дополнить эту статью.
Ржавчина – злейший враг почти всех металлов. «Красная чума» обладает завидным упорством и постоянством, превращая сотни тонн блестящей высококачественной легированной стали в груды коричневого порошка. Болезнь без преград… Но от нее есть лекарства: гальванические покрытия, лаки и краски, битум и мастики – все они, как правило, должны защищать металл. Но на самом деле все не так просто.
Проблема защиты от коррозии стоит очень остро, например, для автомобилистов. Общеизвестно, что если не принять определенные меры, кузов автомобиля за 4-5 лет может превратиться буквально в ржавое сито. Ни лакокрасочные покрытия, ни мастика зачастую не помогают, так как кузов имеет множество закрытых полостей, полостей, карманов и коробов, а дорожная грязь и влага смешиваются с поваренной солью, создавая там идеальные условия для электрохимической коррозии. А учитывая толщину современных автомобильных стальных пластин, это может привести к очень быстрому выходу из строя.
Однако вы можете не только защитить себя от коррозии с помощью брони из лака или хрома, но и обмануть коррозию, подсунув в качестве приманки такие лакомые кусочки, как металлы с более высоким электродным потенциалом.
Электродный потенциал? Какое отношение она имеет к коррозии металла? Оказывается, она самая прямая.
Когда два металлических электрода, электрически соединенных друг с другом, помещают в емкость с электролитом, один начинает растворяться, а другой остается неповрежденным. Другими словами, видно, что металлы с высоким электродным потенциалом растворяются. Это свойство гальванической пары позволило защитить кузов автомобиля от электрохимической коррозии с помощью эффекта катодной консервации.
Верфи уже давно используют этот принцип для защиты внутренней части трюма корабля от коррозии. Внутри корпуса размещен специальный металлический анод (изготовленный из металла с более высоким электродным потенциалом, чем металл корпуса). Этот метод недавно взяли на вооружение автомобилисты.
Для анодной защиты используются ребристые цинковые детали (для увеличения площади поверхности) и с помощью встроенных постоянных магнитов крепятся к наиболее труднодоступным и загрязненным участкам тела. Электрические соединения выполняются многожильным проводом, а цинковый анод крепится к корпусу с помощью винтов.
Дорожная грязь, влага и поваренная соль скапливаются на ребрах, и комплект из цинковой стали начинает вести себя как знакомый гальванический элемент. При работе такой «батарейки» цинковый анод растворяется, но катод при этом не расходуется.
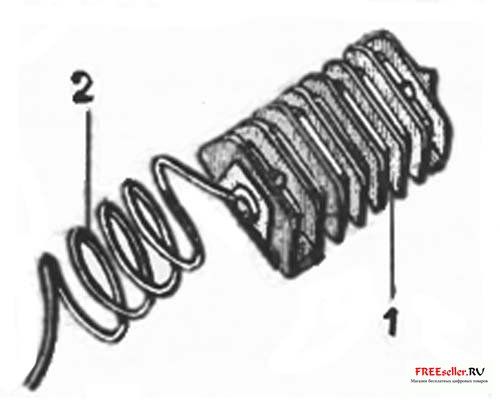
Рис. 1. Комплект защиты корпуса от анодирования:
1 – оребренный цинковый электрод, 2 – соединительный провод.
Поскольку сталь – это прежде всего сплав железа и углерода, вещества с разными электродными потенциалами, процесс коррозии аналогичен работе гальванического элемента. При нанесении электролита на поверхность такого сплава между молекулами железа и углерода начинается электрохимическая реакция, в результате которой анод (железо) растворяется и превращается в гидрат, а затем в оксид.
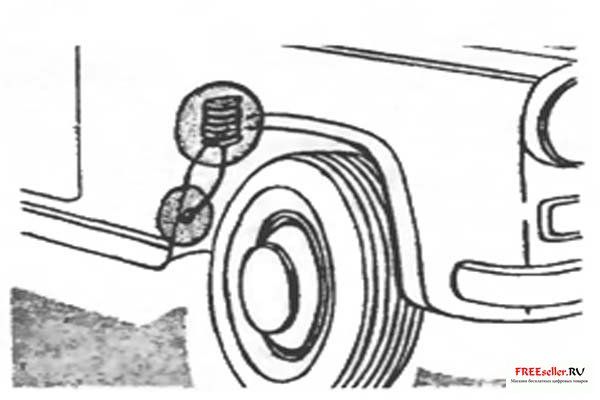
Рис. 2. Крепление электрода к арке колеса.
Наличие цинкового электрода, электрически связанного с основным металлом, радикально меняет ситуацию. По сравнению с железом и углеродом цинк является металлом с более высоким электродным потенциалом и действует как анод. Поэтому при наличии проводящей среды, которая практически всегда присутствует на поверхности кузова автомобиля, происходит электрохимическая реакция с растворением анода (цинка), при этом катод, т.е металл металла, сохраняется тело.
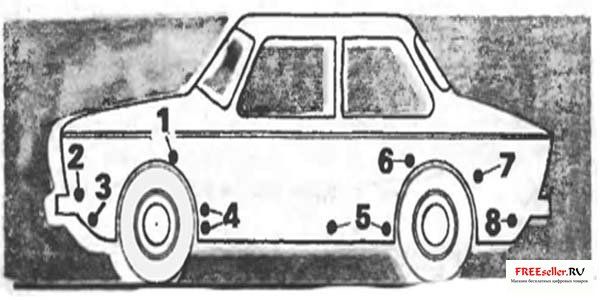
Рис. 3. Наиболее эффективно крепить электроды в следующих местах:
1 — усилитель брызговика коробки, 2 — корпус фары и места крепления габаритных огней, 3 — нижняя часть передней панели, 4 — полость за щитком усилителя в переднем крыле, 5 — внутренняя сторона двери, 6, 7 — заднее крыло Колесная арка в передней нижней части и стыке с крылом, 8 – фартук задней панели.
Эксперименты показали, что цинковый электрод размером со спичечный коробок служит от 3 до 5 лет.
Обмануть «красную чуму». Кормите ее – кусок металла с более высоким электродным потенциалом, чем сталь. На вашем автомобиле быстро нарастает коррозия, и вы забываете о кузове как минимум на три года.
- Хотите связаться со мной?






